La Comisión Europea aprueba V116, la vacuna antineumocócica conjugada 21-valente de MSD para la prevención de la enfermedad neumocócica invasiva y la neumonía neumocócica en adultos
April 1, 2025 10:37 am GMT+0000
- La decisión de la Comisión Europea (CE) constituye la cuarta aprobación del fármaco para la vacunación antineumocócica en adultos
Madrid, 1 de abril de 2025 – MSD (marca comercial de Merck & Co., Inc., Rahway, N.J., USA) (NYSE: MRK) ha anunciado que la Comisión Europea (CE) ha aprobado CAPVAXIVE® (vacuna antineumocócica conjugada 21-valente), para la inmunización activa para la prevención de la enfermedad invasiva y la neumonía causadas por los serotipos de Streptococcus pneumoniae 3, 6A, 7F, 8, 9N, 10A, 11A, 12F, 15A, 15B, 15C, 16F, 17F, 19A, 20A, 22F, 23A, 23B, 24F, 31, 33F y 35B en individuos de 18 años o más. Se trata de una vacuna antineumocócica diseñada específicamente para ayudar a proteger a los adultos frente a los serotipos que causan la mayoría de los casos de enfermedad neumocócica invasiva (ENI). La aprobación de la vacuna por parte de la CE se basa en datos de seguridad e inmunogenicidad del programa clínico de fase III STRIDE.
Esta decisión autoriza la comercialización de la vacuna en los 27 estados miembros de la Unión Europea (UE), así como en Islandia, Liechtenstein y Noruega. Su disponibilidad en cada país dependerá de varios factores, incluido el cumplimiento de los procedimientos de reembolso. La vacuna fue aprobada en los EE.UU. en junio de 2024, en Canadá en julio de 2024 y en Australia en enero de 2025.
“La enfermedad neumocócica sigue representando un riesgo significativo para los adultos en Europa, especialmente para aquellos de 65 años o más, así como para los adultos más jóvenes que están inmunocomprometidos o padecen enfermedades crónicas”, explica la Dra. Lina Pérez Breva, del Departamento de Investigación de Vacunas en Fisabio – Salud Pública de Valencia. “Basándonos en los datos del programa clínico de fase III STRIDE, la vacuna ofrece cobertura contra los serotipos responsables de la mayoría de los casos de enfermedad invasiva en adultos, lo que convierte esta aprobación en la UE en un paso importante para ayudar a proteger a los adultos de la enfermedad neumocócica”.
“Al centrarse en los serotipos que han sido responsables de una mayor parte de casos de enfermedad neumocócica invasiva en adultos, esta vacuna nos ayuda a proteger específicamente a los adultos”, explica la Dra. Paula Annunziato, vicepresidenta sénior de enfermedades infecciosas y vacunas, Desarrollo Clínico Global de los Laboratorios de Investigación de MSD. “Estamos orgullosos de ofrecer esta vacuna a los adultos en Europa para que puedan beneficiarse de su amplia protección y estamos entusiasmados por seguir trabajando con las autoridades regulatorias para expandir la disponibilidad de la vacuna a nivel mundial”.
La siguiente tabla muestra la cobertura de serotipos responsables de la enfermedad neumocócica invasiva (ENI) en adultos de diferentes países de la UE para V116:
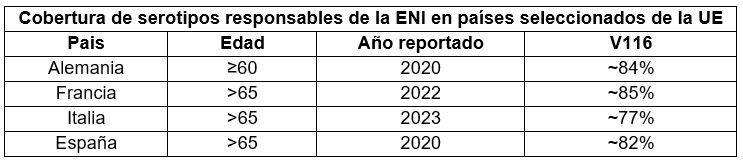
Los datos incluidos corresponden a países seleccionados según su pertenencia a la UE, el tamaño de su población y el año más reciente disponible. Estos valores se basan en datos epidemiológicos a nivel nacional, por lo que pueden existir variaciones regionales; no reflejan la eficacia de la vacuna.
La decisión de la CE sigue la recomendación positiva del Comité de Medicamentos para Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA), emitida en enero de 2025 y se basó en los resultados del ensayo pivotal de fase III STRIDE-3 (NCT05425732), que evaluó V116 en comparación con PCV20 en adultos mayores de 18 años que no habían recibido previamente una vacuna antineumocócica, y STRIDE-10 (NCT05569954), que comparó V116 con PPSV23 (vacuna antineumocócica polivalente 23-valente) en adultos de 50 años o más que no habían recibido previamente una vacuna antineumocócica. La aprobación también se respalda con los resultados de los ensayos fase III STRIDE-4 (NCT05464420), STRIDE-5 (NCT05526716), STRIDE-6 (NCT05420961), y STRIDE-7 (NCT05393037) (ver ‘Datos clínicos que respaldan la aprobación de la CE’ a continuación, para más detalles).
Datos clínicos que respaldan la aprobación de la CE
V116 fue aprobada por la CE en base a datos que incluyeron estudios clínicos de Fase III diseñados para evaluar su perfil de seguridad e inmunogenicidad en una variedad de poblaciones adultas. Estos estudios incluyeron:
STRIDE-3 (NCT05425732): Un estudio doble ciego de fase III que evaluó V116 en comparación con PCV20 en personas de 18 años o más que no habían recibido previamente una vacuna antineumocócica. Los participantes de 50 años o más fueron asignados a la cohorte 1 (n=2.362) y los participantes de 18 a 49 años a la cohorte 2 (n=300). Los participantes fueron aleatorizados para recibir una dosis única de V116 o PCV20. Los resultados del estudio incluyen:
- En personas de 50 años o más (cohorte 1), V116 no fue inferior a PCV20 para los 10 serotipos compartidos por ambas vacunas (3, 6A, 7F, 8, 10A, 11A, 12F, 19A, 22F, 33F), según lo evaluado por los títulos medios geométricos (GMTs, por sus siglas en inglés) de actividad opsonofagocitica (OPA, por sus siglas en inglés) específicos de serotipo al mes de la vacunación;
- V116 fue superior a PCV20 para 10 de los 11 serotipos incluidos en V116 pero no en PCV20 (9N, 15A, 16F, 17F, 20A, 23A, 23B, 24F, 31, 35B), según lo evaluado por los GMTs de OPA específicos de serotipo 1 mes después de la vacunación y las proporciones de pacientes con un aumento mayor o igual a cuatro veces en OPA desde la prevacunación hasta 1 mes después de la vacunación;
- Se observaron respuestas inmunitarias para el serotipo 15C en los participantes que recibieron V116, pero no cumplieron los criterios de superioridad estadística;
- En personas de 18 a 49 años de edad (cohorte 2), V116 provocó respuestas inmunes no inferiores (inmunopuente) en comparación con personas de 50 a 64 años de edad, según lo evaluado por los GMTs de OPA serotipo-específicos 1 mes después de la vacunación;
- En ambas cohortes, V116 tuvo un perfil de seguridad comparable a PCV20.
STRIDE-10 (NCT05569954): Un estudio aleatorizado, doble ciego, de fase III que evaluó V116 en comparación con PPSV23 en personas de 50 años de edad o más que no habían recibido previamente una vacuna conjugada antineumocócica (n=1.484). Los resultados del estudio incluyen:
- V116 no fue inferior a PPSV23 para los 12 serotipos comunes y fue superior a PPSV23 para los nueve serotipos únicos de V116, según lo evaluado por los GMTs de OPA específicos de serotipo 30 días después de la vacunación;
- La proporción de pacientes con un aumento de ≥4 veces en las ratios de GMT de OPA desde el día 1 hasta el día 30 para la OPA específica de serotipo para V116 fue superior a PPSV23 para ocho de los nueve serotipos únicos de V116 en comparación con PPSV23;
- V116 mostró un perfil de seguridad comparable al de PPSV23.
STRIDE-4 (NCT05464420): Un estudio aleatorizado, doble ciego, de fase III de consistencia entre lotes que evaluó V116 en personas de 18 a 49 años que no habían recibido previamente una vacuna conjugada antineumocócica (n=2.162). Los participantes fueron aleatorizados para recibir una dosis única de uno de los tres lotes de V116 o PPSV23 (vacuna antineumocócica polisacárida 23-valente). Los resultados del estudio incluyen:
- En los tres lotes, V116 generó una respuesta inmunitaria equivalente, según lo evaluado por los GMTs de OPA y las concentraciones medias geométricas (GMCs, por sus siglas en inglés) de Inmunoglobulina G (IgG) 30 días después de la vacunación;
- Los GMTs de OPA fueron generalmente comparables entre los lotes combinados de V116 y los grupos de PPSV23 para los serotipos comunes, y fueron más altos en el grupo de V116 para los serotipos únicos de V116;
- V116 mostró un perfil de seguridad equivalente al de PPSV23.
STRIDE-5 (NCT05526716): Un estudio aleatorizado, doble ciego, de fase III, que evaluó V116 cuando se administró de forma concomitante o secuencial (30 días después) con la vacuna de gripe cuadrivalente (QIV, por sus siglas en inglés) en adultos de 50 años o más (n=1.080). Los resultados del estudio incluyen:
- Para los criterios de valoración primarios de inmunogenicidad, V116 administrada concomitantemente con QIV fue no inferior a V116 administrada secuencialmente con QIV para 20 de los 21 serotipos de V116 según la evaluación de los GMTs de OPA, así como para tres de las cuatro cepas de gripe de QIV, según lo evaluado por los GMTs de inhibición de la hemaglutinación (HAI, por sus siglas en inglés) al mes de la vacunación);
- Las tasas y la gravedad de las reacciones adversas sistémicas solicitadas y de las reacciones adversas locales solicitadas en el lugar de inyección de V116 fueron similares cuando V116 se administró con o sin QIV inactivada.
STRIDE-6 (NCT05420961): Un estudio descriptivo aleatorizado de fase III que evaluó V116 en personas de 50 años o más que habían recibido previamente una vacuna antineumocócica al menos un año antes del reclutamiento. Los participantes se inscribieron en una de las tres cohortes en función de su historial previo de vacunación antineumocócica (cohorte 1: PPSV23 [vacuna antineumocócica polisacárida 23-valente], cohorte 2: PCV13 [vacuna neumocócica conjugada 13-valente], o cohorte 3: PPSV23 seguida o precedida de PCV13, PPSV23 precedida de PCV15 [vacuna antineumocócica conjugada 15-valente], o PCV15 sola). Los participantes de la cohorte 1 fueron aleatorizados para recibir V116 (n=231) o PCV15 (n=119), los participantes de la cohorte 2 fueron aleatorizados para recibir V116 (n=176) o PPSV23 (n=85), y los participantes de la cohorte 3 fueron aleatorizados para recibir V116 (n=106). En cada una de las 3 cohortes, se evaluaron los GMTs de OPA específicas del serotipo y la proporción de personas con un aumento ≥4 veces en las respuestas de OPA desde el inicio hasta 1 mes después de la vacunación. Los resultados del estudio incluyen:
- En la cohorte 1, V116 provocó respuestas de OPA comparables a PCV15 para los 6 serotipos comunes, y más altos para los 15 serotipos únicos y el serotipo 15B;
- En la cohorte 2, V116 provocó respuestas de OPA comparables a PPSV23 para los 12 serotipos comunes y el serotipo 15B, y más altos para los 9 serotipos únicos;
- Las respuestas de OPA a V116 fueron similares en las 3 cohortes de participantes que habían recibido previamente una o más vacunas antineumocócicas;
- V116 tuvo un perfil de seguridad comparable al de PCV15 y PPSV23.
STRIDE-7 (NCT05393037): Un estudio doble ciego de fase III que evaluó V116 en personas de 18 años o más con el virus de la inmunodeficiencia humana (VIH) (n=304) que no habían recibido vacuna antineumocócica o que tenían experiencia previa con la vacuna antes del estudio. Los participantes fueron aleatorizados para recibir V116 o PCV15 + PPSV23. Los resultados del estudio incluyen:
- V116 fue inmunogénica para todos los serotipos cubiertos por la vacuna, según lo evaluado por los GMTs de OPA y las GMCs de IgG 30 días después de la vacunación;
- V116 generó respuestas inmunitarias comparables a las de PCV15+PPSV23 para los 13 serotipos compartidos y respuestas inmunitarias más altas para los ocho serotipos cubiertos únicamente por V116, según lo evaluado por los GMTs de OPA específicos de serotipo y las GMCs de IgG a los 30 días;
- Menos participantes experimentaron eventos adversos (EAs) con V116 (71,6%) en comparación con PCV15+PPSV23 (91%), principalmente debido a menos EAs en el sitio de inyección.
Sobre V116
V116 es la vacuna antineumocócica conjugada 21-valente de MSD para la inmunización activa para la prevención de la enfermedad invasiva y la neumonía en adultos mayores de 18 años. V116 está específicamente diseñada para ayudar a hacer frente a los serotipos de Streptococcus pneumoniae predominantemente responsables de la enfermedad neumocócica invasiva (ENI) en adultos, incluyendo ocho serotipos únicos, 15A, 15C, 16F, 23A, 23B, 24F, 31 y 35B en comparación con otras vacunas antineumocócicas.
Indicación de la EMA para CAPVAXIVE
CAPVAXIVE está indicada para la inmunización activa para la prevención de la enfermedad invasiva y neumonía causadas por Streptococcus pneumoniae en personas a partir de 18 años de edad.
El uso de CAPVAXIVE se debe realizar de acuerdo con las recomendaciones oficiales.
Acerca de la enfermedad neumocócica
La enfermedad neumocócica es una infección causada por una bacteria llamada Streptococcus pneumoniae. Existen aproximadamente 100 tipos diferentes (denominados serotipos) de esta bacteria, los cuales pueden afectar a los adultos de manera diferente a los niños. La enfermedad neumocócica puede ser invasiva o no invasiva. Las enfermedades neumocócicas no invasivas incluyen la neumonía (cuando la infección se limita a los pulmones), mientras que las enfermedades neumocócicas invasivas incluyen la bacteriemia neumocócica (infección en el torrente sanguíneo), la neumonía neumocócica bacterémica (neumonía con bacteriemia) y la meningitis neumocócica (infección de las membranas que recubren el cerebro y la médula espinal). La neumonía neumocócica es un tipo de neumonía bacteriana, que es la presentación clínica más común de la enfermedad neumocócica en adultos.
Sobre MSD
En MSD -conocida como Merck & Co., Inc. en Estados Unidos y Canadá, con sede en Rahway, Nueva Jersey- estamos unidos por nuestro propósito de emplear el potencial de la ciencia para salvar y mejorar vidas en el mundo. Desde hace más de 130 años, hemos aportado esperanza a través del desarrollo de importantes medicamentos y vacunas. Aspiramos a ser la compañía líder de investigación biofarmacéutica del mundo y, en la actualidad, estamos a la vanguardia de la investigación en soluciones innovadoras de salud para avanzar en la prevención y tratamiento de enfermedades humanas y animales. Fomentamos un espacio de trabajo diverso e inclusivo y trabajamos de forma responsable todos los días para conseguir un futuro seguro, sostenible y saludable para todas las personas y comunidades. Para más información, visita www.msd.es conecta con nosotros en X (antes Twitter), LinkedIn y Youtube.
Declaraciones de Futuro de MSD (marca comercial de Merck & Co., Inc., Rahway, N.J., USA)
Esta nota de prensa de MSD, marca de Merck & Co., Inc., Rahway, N.J., USA, (la Compañía), incluye “declaraciones prospectivas” dentro del significado de las disposiciones de puerto seguro de la Ley de Reforma de Litigios de Valores Privados de EE. UU. de 1995. Estas declaraciones se basan en las creencias y expectativas actuales de la dirección de la compañía y están sujetas a riesgos e incertidumbres significativos. No se puede garantizar que los candidatos de la cartera reciban las aprobaciones regulatorias necesarias ni que sean comercialmente exitosos. Si los supuestos subyacentes resultan inexactos o si los riesgos o incertidumbres se materializan, los resultados reales podrían diferir materialmente de los establecidos en las declaraciones prospectivas.
Los riesgos e incertidumbres incluyen, entre otros, las condiciones generales de la industria y la competencia; factores económicos generales, incluidas las fluctuaciones de las tasas de interés y los tipos de cambio; el impacto de la regulación de la industria farmacéutica y la legislación de atención médica en los Estados Unidos e internacionalmente; las tendencias globales hacia el control de los costos de atención médica; avances tecnológicos, nuevos productos y patentes obtenidas por los competidores; los desafíos inherentes al desarrollo de nuevos productos, incluida la obtención de la aprobación regulatoria; la capacidad de la compañía para predecir con precisión las condiciones del mercado futuro; dificultades o retrasos en la fabricación; inestabilidad financiera de las economías internacionales y el riesgo soberano; la dependencia de la efectividad de las patentes de la compañía y otras protecciones para productos innovadores; y la exposición a litigios, incluidos los litigios de patentes, y/o acciones regulatorias.
La compañía no asume ninguna obligación de actualizar públicamente ninguna declaración prospectiva, ya sea como resultado de nueva información, eventos futuros o de otro tipo. Factores adicionales que podrían causar que los resultados difieran materialmente de los descritos en las declaraciones prospectivas pueden encontrarse en el Informe Anual de la compañía en el Formulario 10-K para el año que terminó el 31 de diciembre de 2024 y en otras presentaciones de la compañía ante la Comisión de Bolsa y Valores de EE. UU. (SEC), disponibles en el sitio web de la SEC (www.sec.gov).
Contacto para medios locales
MSD
Sara Cebrián – Jorge Ramírez | 91 321 06 00
ALABRA
Rocío Galán | 673 27 07 45 | rocio.galan@alabra.es
Helena Pastor | 647 24 16 15 | helena.pastor@alabra.es
